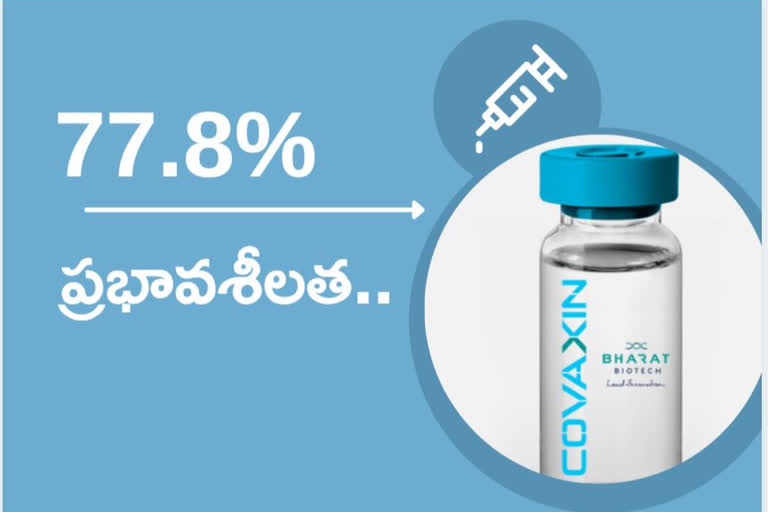
భారత్ బయోటెక్కు చెందిన ‘కొవాగ్జిన్’ (covaxin) టీకాకు 77.8 శాతం ప్రభావశీలత ఉన్నట్లు మూడో దశ క్లినికల్ పరీక్షల తుది విశ్లేషణలో నిర్ధారణ అయినట్లు తెలిసింది. ఈ ఫలితాలను పరిశీలించిన సబ్జెక్టు నిపుణుల కమిటీ (ఎస్ఈసీ).. కొవాగ్జిన్ టీకాకు అనుమతి ఇవ్వాలని భారత ఔషధ నియంత్రణ మండలి (DCGI)కి సిఫారసు చేసినట్లు సమాచారం. సబ్జెక్టు నిపుణుల కమిటీ.. డీసీజీఐకి అనుబంధంగా పనిచేస్తుంది. ‘కొవాగ్జిన్’ టీకాపై మూడో దశ క్లినికల్ పరీక్షలను దేశవ్యాప్తంగా 25,000 మందికి పైగా వాలంటీర్లపై నిర్వహించిన విషయం తెలిసిందే. ఈ పరీక్షల సమాచారాన్ని ఇప్పటికే రెండు దఫాలుగా విశ్లేషించారు. చివరిదైన మూడో దఫా విశ్లేషణలోనూ ఈ టీకా భద్రత, సామర్థ్యం నిర్ధారణ అయినందున, దీనికి డీసీజీఐ నుంచి తుది అనుమతి లభించే అవకాశం ఉందని సంబంధిత వర్గాలు పేర్కొంటున్నాయి.
‘కొవాగ్జిన్’ టీకాకు ప్రపంచ ఆరోగ్య సంస్థ (డబ్ల్యూహెచ్ఓ) నుంచి అత్యవసర వినియోగ అనుమతి (ఈయూఏ) కోసం భారత్ బయోటెక్(bharat biotech) దరఖాస్తు చేసిన విషయం తెలిసిందే. దీనిపై ‘ప్రీ-సబ్మిషన్’ సమావేశం బుధవారం (23న) జరగనుంది. మూడో దశ క్లినికల్ పరీక్షల సమాచారాన్ని, విశ్లేషణను డబ్ల్యూహెచ్ఓ(WHO)కు భారత్ బయోటెక్ అందించే అవకాశాలు ఉన్నాయి. దీనికి ఒకరోజు ముందుగానే దీన్ని సబ్జెక్టు నిపుణుల కమిటీ పరిశీలించి, తుది అనుమతి కోసం డీసీజీఐకి సిఫారసు చేయటం ప్రాధాన్యం సంతరించుకుంది. ఈ అదనపు సమాచారంతో ‘కొవాగ్జిన్’ టీకాకు అత్యవసర అనుమతి లభించే అవకాశాలు మెరుగుపడినట్లు భావిస్తున్నారు.
మరో 2 దశలు...
కొవాగ్జిన్కు అత్యవసర అనుమతి లభించడానికి ఇంకా 2 దశలు ఉన్నాయి. ప్రీ-సబ్మిషన్ సమావేశం తర్వాత టీకా అనుమతి దరఖాస్తును సమీక్ష కోసం డబ్ల్యూహెచ్ఓ స్వీకరిస్తుంది. ఆ క్రమంలో అదనపు సమాచారాన్ని కోరవచ్చు. తర్వాతే తుది నిర్ణయం ప్రకటిస్తుంది. ఇది వచ్చే రెండు, మూడు నెలల వ్యవధిలో పూర్తయ్యే అవకాశమున్నట్లు తెలుస్తోంది. ‘కొవాగ్జిన్’ టీకాపై మూడో దశ క్లినికల్ పరీక్షల సమాచారాన్ని అంతర్జాతీయ సైన్స్ పత్రికల్లో సమీక్ష కోసం అందించాల్సి ఉంది.
ఇదీ చూడండి: