हैदराबाद : क्लीनिकल ट्रायल एक प्रकार का शोध है जो नए परीक्षणों और उपचार का अध्ययन करता है. मानव स्वास्थ्य परिणामों पर उनके प्रभावों का मूल्यांकन करता है. वालंटियर दवाओं का कोशिकाओं और अन्य जैविक उत्पादों, शल्य चिकित्सा प्रक्रियाओं, रेडियोलॉजिकल प्रक्रियाओं, उपकरणों, व्यवहार उपचार और निवारक देखभाल सहित चिकित्सा हस्तक्षेपों का परीक्षण पाने के लिए इस क्लीनिकल ट्रायल में भाग लेते हैं.
यह ट्रायल सावधानीपूर्वक डिजाइन किए गए, समीक्षा किए गए और पूरे किए गए होते हैं. इसको शुरू करने से पहले उन्हें मंजूरी लेने की आवश्यकता होती है. बच्चों सहित सभी उम्र के लोग इन क्लीनिकल ट्रायल में भाग ले सकते हैं.
बायोमेडिकल क्लिनिकल परीक्षण के 4 चरण
- चरण I- इस चरण में एक छोटे समूह के ऊपर नई दवाओं का परीक्षण किया जाता है, जिसमें सुरक्षित खुराक सीमा का मूल्यांकन और दुष्प्रभावों की पहचान की जाती है.
- चरण II- पहले चरण के उपचार में सुरक्षित पाए गए परीक्षण का अध्य्यन करता है, लेकिन परीक्षण के दूसरे प्रतिकूल प्रभावों की निगरानी के लिए मानव के बड़े समूह की आवश्यकता है.
- चरण III- अध्ययन बड़ी आबादी और विभिन्न क्षेत्रों और देशों में आयोजित किए जाते हैं. यह नए उपचार को मंजूरी देने से पहले का कदम है.
- चरण IV- देश में नए उपचार को मंजूरी के बाद इसका अध्य्यन किया जाता है. इस चरण में आगे के समय के लिए ज्यादा आबादी पर इसके परीक्षण की आवश्यकता होती है.
भारत में ड्रग्स और कॉस्मेटिक अधिनियम
दिसंबर 2016 में ड्रग्स एंड कॉस्मेटिक एक्ट 1945 में किए गए संशोधन के अनुसार मानव पर क्लीनिकल ट्रायल में होने वाले प्रतिकूल प्रभावों में मुआवजे का भी प्रावधान है. ऐसे में व्यक्ति वित्तीय मुआवजे के लिए भी हकदार होंगे.
डीसीजी ने कहा कि ट्रायल शुरू होने से पहले स्पॉन्सर को लिखित रूप में यह देना होता है कि यदि इस ट्रायल के कोई साइड इफेक्ट होते हैं तो, स्पॉन्सर ही सारे मेडिकल प्रबंधन का खर्च वहन करेगा, वह तुरंत चिकित्सा प्रबंधन प्रदान करने के साथ मुआवजे का भी भुगतान करेगा.
ड्रग्स कंट्रोलर जनरल ऑफ इंडिया (डीसीजीआई) वीजी सोमानी ने उन प्रतिभागियों को 12 करोड़ रुपये का मुआवजा देने का आदेश दिया है, जिन्होंने क्लिनिकल परीक्षण किया और पिछले तीन वर्षों में गंभीर प्रतिकूल प्रभाव झेला.
क्लीनिकल परीक्षण की रजिस्ट्री
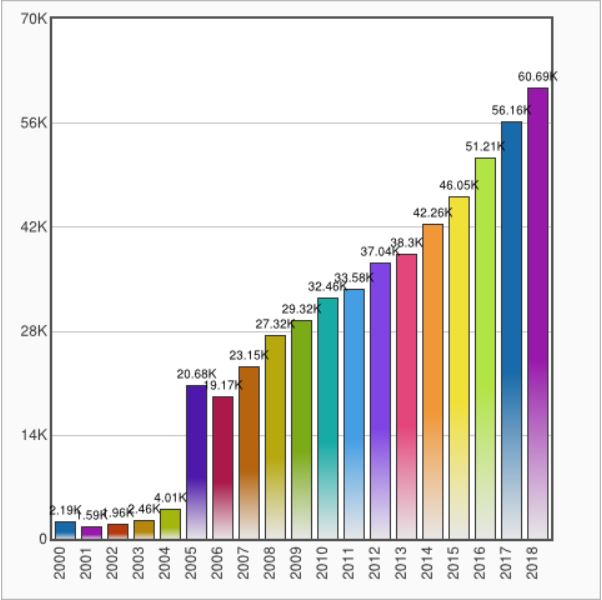
ऑनलाइन सार्वजनिक रिकॉर्ड प्रणाली (CTRI) के सरकारी आंकड़ों के अनुसार भारत में ट्रायल के लिए पंजीकरण कराने वालों की संख्या में लगातार वृद्धि हुई है. स्वास्थ्य मंत्रालय ने कहा कि 2015 में 859 पंजीकृत परीक्षण हुए, 2016 में 873, 2017 में 2,516 और 2018 नवंबर तक 3,869 पंजीकरण हुए.
हालांकि ऐसे वॉलंटियर की संख्या ज्यादा है, जिनकी भागीदारी के लिए उन्हें मुआवजा दिया जा रहा है. सीडीएससीओ ने 2015 में 381, 2016 में 378, 2017 में 345 और 2018 में 339 वॉलंटियर की मौतों की सूचना दी. सीडीएससीओ की नैतिकता समिति ने कहा इन मौतों में सीधे 2015 में 18, 2016 में 27, 2017 में 30 और 2018 में 13 परीक्षणों से जुड़ी थीं.
मुआवजे की राशि
गैर सरकारी संगठन ऑल इंडिया ड्रग्स एक्शन नेटवर्क की संयोजक मालिनी आइसाला ने कहा कि यह बहुत ही दुखद है कि इस तरह की महत्वपूर्ण डेटा सार्वजनिक डोमेन में उपलब्ध नहीं हैं, लेकिन संसदीय प्रक्रिया के माध्यम से इसे एक्सेस किया जा सकता है.
उन्होंने कहा कि एक कानून के अनुसार नैदानिक परीक्षणों में भाग लेने वाले वॉलंटियर या उसके परिवारों को न्यूनतम 8 लाख रुपये का मुआवजा मिलना चाहिए. मंत्रालय की खुद के आंकड़ों के मुताबिक 2018 की एकमात्र रिपोर्ट की गई मौत के मामले में परिवार को सिर्फ 4.87 लाख रुपये दिए गए.
2015 में सभी 18 प्रतिभागियों के परिवारों को मुआवजा मिला. अगले वर्ष 2016 में 27 में से 25 को मुआवजा दिया गया. 2017 में यह 30 में से 18 और 2018 में 13 मौतों में से 1 की मौतें हो गई थी.
डब्लूएचओ की प्रतिक्रिया
क्लीनिकल ट्रायल में आमतौर पर एक से अधिक चिकित्सा या अनुसंधान संस्थान के प्रतिभागी शामिल होते हैं और अक्सर यह एक से अधिक देशों में होते हैं. जैसा कि प्रत्येक देश की क्लीनिकल ट्रायल के लिए अपनी आवश्यकताएं होती हैं यह संभव है कि एकल परीक्षणों को एक से अधिक रजिस्ट्री शामिल हो सकती है. हालांकि एक से अधिक रजिस्ट्री डेटाबेस पर दिखाई दे सकती है.
डब्ल्यूएचओ का अंतरराष्ट्रीय नैदानिक परीक्षण रजिस्ट्री प्लेटफॉर्म क्लीनिकल परीक्षण को वैश्विक स्तर पर रजिस्टर करता है ताकि रोगियों, परिवारों, रोगी समूहों और अन्य लोगों द्वारा जानकारी की पहुंच बढ़ सके.
अंतरराष्ट्रीय नैदानिक परीक्षण रजिस्ट्री प्लेटफॉर्म एक वैश्विक पहल है, जिसका उद्देश्य सार्वजनिक रूप से उपलब्ध सभी क्लीनिकल परीक्षणों के बारे में मनुष्यों को जानकारी देना है.
इसका कई और उद्देश्य भी है-
- पंजीकृत क्लीनिकल परीक्षण डेटा की समझ, पूर्णता और सटीकता में सुधार.
- संचार और क्लीनिकल परीक्षणों को पंजीकृत करने की आवश्यकता के बारे में जागरूकता बढ़ाना.
- पंजीकृत डेटा की पहुंच सुनिश्चित करना.
- क्लीनिकल परीक्षण पंजीकरण के लिए क्षमता का निर्माण.
- पंजीकृत डेटा के उपयोग को प्रोत्साहित करना.
- ICTRP की स्थिरता सुनिश्चित करना.