यूनाइट्स स्टेट्स: रिसर्च टीम का सह-नेतृत्व करने वाले इंजीनियरिंग के सहायक प्रोफेसर, लुइस सोलोरियो ने कहा कि स्तन कैंसर की प्रमुख विशेषताओं में से एक यह है कि ज्यादातर रोगी जीवित रहते हैं यदि रोग स्थिर रहता है, लेकिन कोशिकाओं के मेटास्टासाइज होने पर सर्वाइवल में 70% से अधिक गिरावट होती है. हालांकि, एक बार कोशिकाएं प्राथमिक ट्यूमर को छोड़ देती हैं तो वे अक्सर उन दवाओं के लिए उत्तरदायी नहीं होती हैं जो शुरू में रोगी के लिए काम करती थीं. हम एक ऐसी प्रणाली विकसित करना चाहते थे जो हमें बेहतर तरीके से यह समझने में मदद कर सकें कि नए अंग में आक्रमण के समय नए ऊतक प्रभावित ट्यूमर कोशिकाओं की फिजियोलॉजी कैसी होती है.
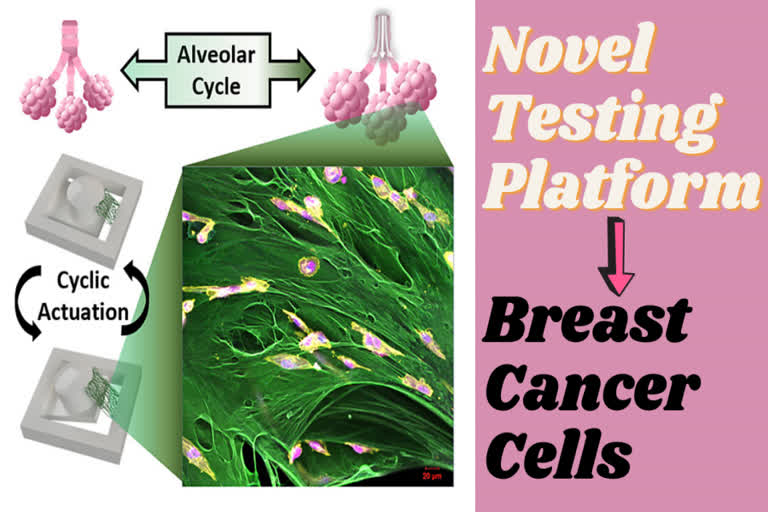
- पर्ड्यू शोधकर्ताओं ने एक चुंबकीय रूप से घूमती सेल संवर्धन प्रणाली बनाई, जहां कैंसर कोशिकाओं को एक निलंबित बाह्य मैट्रिक्स प्रोटीन पर 3 डी में बनाया जा सकता है जो यांत्रिक बलों के प्रभाव का मूल्यांकन करने के लिए शुरुआती मेटास्टैटिक फेफड़ों के ऊतकों में प्रचुर मात्रा में है.
- वे इस ऊतक की नकल में तनाव के ऐम्प्लिटूड और सांस लेने की दर को शामिल करने में सक्षम थे. शोधकर्ताओं ने पाया कि कोशिकाएं इन परिस्थितियों में विभाजित होना छोड़ देती हैं. यह रिसर्च अड्वैन्स्ट फंगक्शनल मटेरियल्स में प्रकाशित हुआ है.
औषधीय रसायन विज्ञान और आणविक औषध विज्ञान के एक एसोसिएट प्रोफेसर माइकल वेंड्ट ने कहा कि इससे पहले कभी भी गति की अवधारणा को ट्यूमर माइक्रोएन्वायरमेंट के एक घटक के रूप में नहीं जाना गया था. अब हम समझते हैं कि स्वस्थ अंग मेटास्टैटिक कॉलोनाइजेशन का विरोध करने के लिए गति का उपयोग करते हैं. इस माइक्रोएक्ट्यूएटर प्रणाली का विकास न केवल मेटास्टेसिस की बढ़ती जैविक समझ को पैदा करना जारी रखेगा, बल्कि यह हमारे लिए कैंसर की प्रगति के सबसे घातक पहलू के औषधीय अवरोधकों के बेहतर मूल्यांकन के लिए एक मंच के रूप में भी काम करेगा.
इंजीनियरिंग के एक सहयोगी प्रोफेसर और बिर्क नैनो टेक्नोलॉजी सेंटर के एक शोधकर्ता, हाइआवन 'ह्यूग' ली ने अनुसंधान दल का नेतृत्व किया.
ली ने कहा कि यह एक सेल कल्चर सिस्टम इंजीनियर के लिए पहला प्रयास है जो एक निलंबित ऊतक पर यांत्रिक बलों को लागू कर सकता है. यांत्रिक उत्तेजना क्षमताओं वाले अधिकांश बायोरिएक्टर फ्लैट गैर-जैविक सब्सट्रेट पर 2 डी सेल कल्चर बढ़ने पर भरोसा करते हैं, हम एक कस्टम चुंबकीय एक्ट्यूएटर का उपयोग कर रहे हैं और एक लघु ऊतक की तरह 3 डी कैंसर कोशिकाओं को विकसित करने के लिए फाइब्रोनेक्टिन की एक परत को निलंबित कर रहे हैं. हमारा सिस्टम कृत्रिम सब्सट्रेट का उपयोग किए बिना शारीरिक पर्यावरण की बेहतर नकल करता है. इस प्लेटफॉर्म का उपयोग करते हुए हम देखते हैं कि कुछ कैंसर कोशिकाएं सांस लेने के चक्रीय खिंचाव के कारण अपने प्रसार को धीमा कर देती हैं.
यह कार्य नए उपकरण के यांत्रिक और जैविक गुणों की विशेषता के लिए पांच विभिन्न प्रयोगशालाओं मे किया गया था.
पर्ड्यू विश्वविद्यालय के बायोमेडिकल इंजीनियरिंग के एक सहायक प्रोफेसर सारा केलवे और मैकेनिकल इंजीनियरिंग के एक सहायक प्रोफेसर एड्रियन बुगांजा टेपोल स्ट्रेचिंग प्रोटीन की यांत्रिक विशेषताओं के साथ काम करते हैं. उन्होंने उपकरण पर विभिन्न स्थानों पर कैंसर कोशिकाओं द्वारा महसूस किए गए उपभेदों की एक मैपिंग को विकसित करने के लिए सामग्री की प्रतिक्रिया को मापा.
डॉक्टरेड की छात्रा और सोलोरियो लैब की सह-लेखिका सारा लिब्रिंग ने कहा कि इस तरह एक नए उपकरण के विकास का हिस्सा होना आश्चर्यजनक है, क्योंकि कई प्रोफेसरों और कई प्रयोगशालाओं की विशेषज्ञता को एक साथ लाकर हम अब गतिशील रूप से चलने वाले फाइब्रोनेक्टिन फाइब्रिल पर कैंसर कोशिकाओं का अध्ययन करने में सक्षम है जो पहले संभव नहीं था.